近日,我组组长叶明亮研究员团队和上海有机化学研究所生物与化学交叉研究中心刘聪研究员团队合作,将硼酸化学引入到甲基化蛋白质组分析方法中,并巧妙利用了精氨酸残基上不同修饰基团的位阻差异,实现了高效的精氨酸二甲基化肽段富集,显著提高了蛋白质甲基化的分析能力;利用此新方法,系统分析了蛋白质分相过程中精氨酸二甲基化的变化,揭示了此类修饰的发生会降低蛋白质的分相能力。
蛋白质精氨酸甲基化是一种调控蛋白质功能的重要翻译后修饰,其与众多疾病的发生发展密切相关。研究表明,精氨酸二甲基化会影响一些神经退行性疾病相关蛋白的液—液相分离,以及相分离所驱动的无膜细胞器的产生。然而,受限于目前精氨酸二甲基化蛋白质组分析技术覆盖率不足,这类研究只聚焦于少数几个蛋白,尚未有系统性研究过精氨酸甲基化对蛋白质相分离的影响。
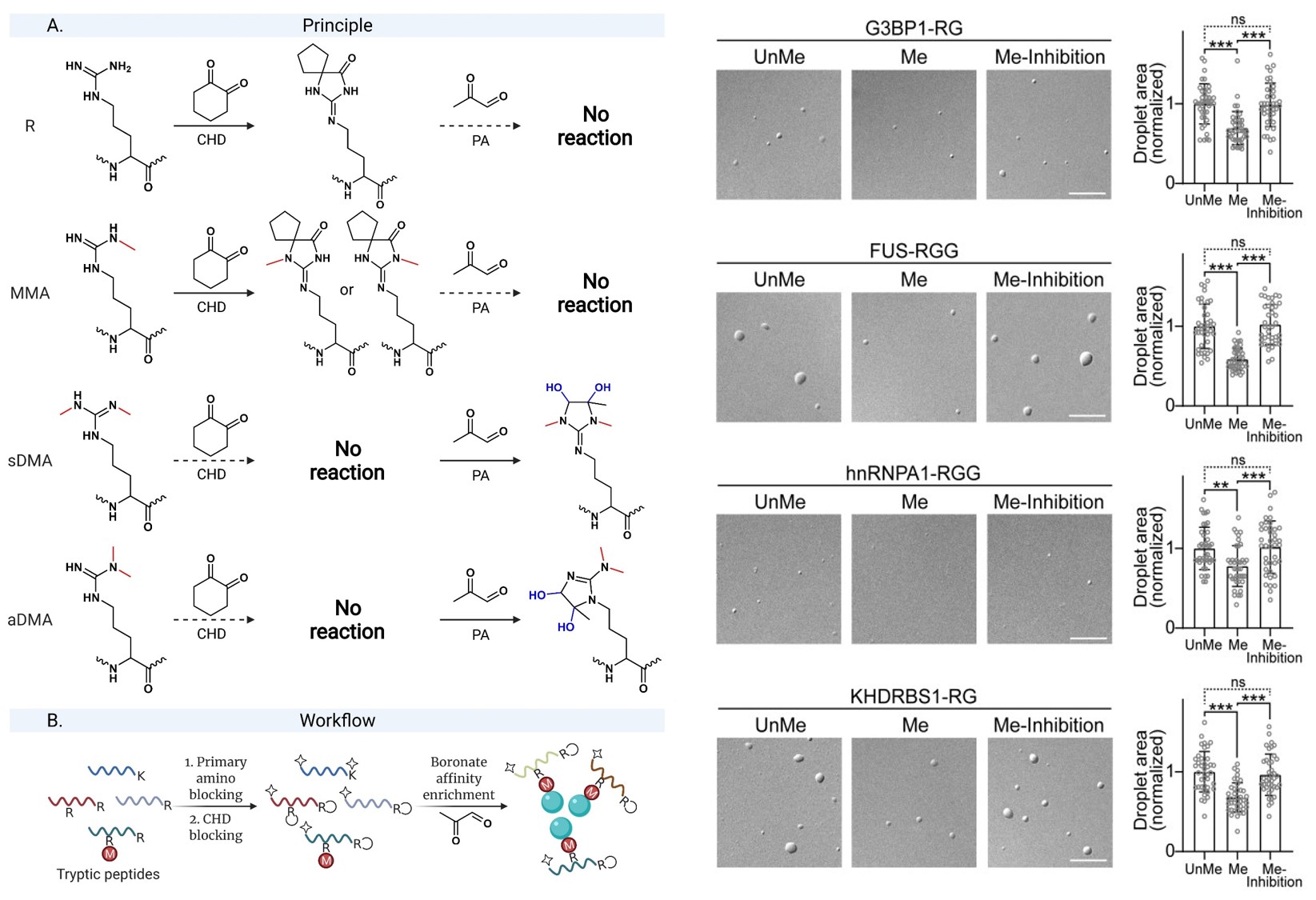
本研究发现,不同甲基化修饰的精氨酸残基在与邻二酮类化合物反应时,由于位阻不同,反应活性差异巨大。合作团队据此设计了一种精氨酸二甲基化肽段的富集方法:先利用环己二酮选择性的封闭无修饰精氨酸残基,随后利用丙酮醛选择性的在二甲基化精氨酸残基上修饰顺式邻二羟基,从而使得硼酸材料可以选择性的富集精氨酸二甲基化肽段。相比传统的免疫亲和富集方法,该方法拥有较强的精氨酸二甲基化肽段富集能力,特别是在鉴定RG/RGG序列上的精氨酸二甲基化位点方面有更高的灵敏度。合作团队将该方法应用于分析蛋白质相分离过程中精氨酸甲基化的变化,发现包括G3BP1,FUS,hnRNPA1、KHDRBS1在内,一些与无膜细胞器或神经退行性疾病密切相关的蛋白质上的精氨酸二甲基化程度发生了显著变化;经一系列实验验证发现,精氨酸甲基化会显著降低这些蛋白质的分相能力,并且上述蛋白质组分析中鉴定到变化的甲基化位点是调控蛋白质相分离的关键因素。本工作开发了基于化学反应的精氨酸二甲基化蛋白质组分析方法,并利用其揭示了精氨酸二甲基化对蛋白质液—液相分离具有重要的调控作用。
叶明亮团队长期致力于蛋白质磷酸化、糖基化、甲基化等翻译后修饰分析新方法的研究,近期发展了基于可逆酶促化学标记的O-GlcNAc糖肽无痕富集方法,克服了标记基团对糖肽质谱检测的干扰,实现了O-GlcNAc糖基化的高灵敏分析( Angew Chem Int Edit, 2022 ) ; 利用不同糖肽的同一肽段骨架具有相似碎裂规律的特点,发展出基于“模式识别”的肽段序列鉴定新方法,实现谱图拓展,显著提高了N-链接位点特异性糖型的鉴定灵敏度,并且可发现未知的糖链及糖链修饰(Nat. Commun., 2022)。
相关成果以“Global profiling of arginine dimethylation in regulating protein phase separation by a steric effect-based chemical-enrichment method”为题,于近日发表在《美国科学院院报》(PNAS)上。上述工作得到国家重点研发计划、国家自然科学基金、我所创新基金等项目的支持。(文/图 王麒)
文章链接:https://doi.org/10.1073/pnas.2205255119